【文:莊以光/超基因生物科技研發部專案經理】
美國生物學家喬治・戴利曾說過「二十一世紀是細胞治療的時代」,廣義來說,二十一世紀就是屬於再生醫療的時代。什麼是「再生」呢?如同爬蟲類在危急時斷尾求生,最後又長出新尾;「再生醫學」透過基因、細胞等相關技術達到再生之目的,幫助受損「細胞」、「組織」或「器官」的修復,期望解決目前醫學難以克服的疾病,提供醫師與病患更多樣的治療選擇。再生醫療是許多重大疾病、罕見疾病的治療曙光,但究竟目前台灣的再生醫療進展到哪裡?哪些治療可以在台灣進行?身處科技不斷日新月異的時代,作為一個關心自身健康的智慧現代人,也應該對再生醫療的現況有基本認識,讓我們從法規來一窺究竟。
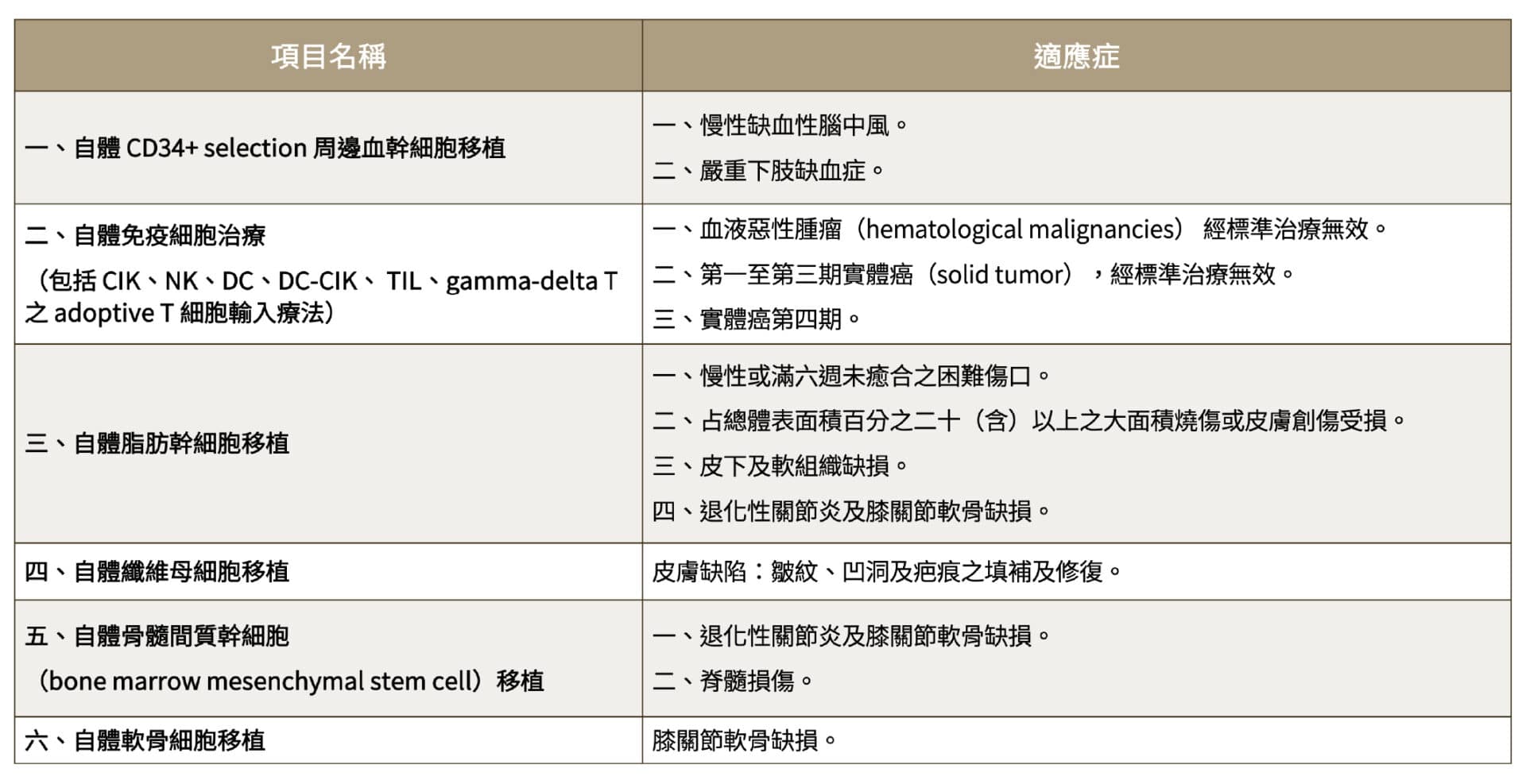
2018年堪稱台灣細胞治療的元年,衛福部於 2018年9月發布「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」(簡稱特管辦法)修正條文,將國外已施行、風險性低,或已經於國內實施人體試驗累積達一定個案數,安全性可確定、成效可預期之細胞治療項目,開放使用於符合適應症之臨床治療,且限於「自體」之細胞治療技術,有助於細胞療法的生技公司與醫療機構的合作,也從此讓有需求的病友在國內就能合法接受治療。2021年2月,衛福部修正了「特管辦法」,刪除了一些療效較差或實際上較少運用的適應症,最終核准了六項細胞治療技術(附表一),並進一步開放「異體細胞治療」;即若要做自體細胞治療以外的技術,計畫內容需載明已自行或參與執行完成之人體試驗成果報告,及其他國內外相關文獻報告,申請臨床試驗通過並有成果後,才可申請異體細胞治療用於病患上。「超基因生技」為通過GTP認證的細胞製備場所,使用授權自日本免疫細胞療法權威照沼裕醫師的專利NK細胞培養技術,與醫療單位合作「NK細胞治療實體癌症技術」,2021年獲衛福部「特管辦法」通過,可進行胰臟癌、肺癌、頭頸癌、子宮頸癌、卵巢癌、乳癌、大腸直腸癌等實體癌治療。
附表一:衛福部特管辦法核准之六項細胞治療技術
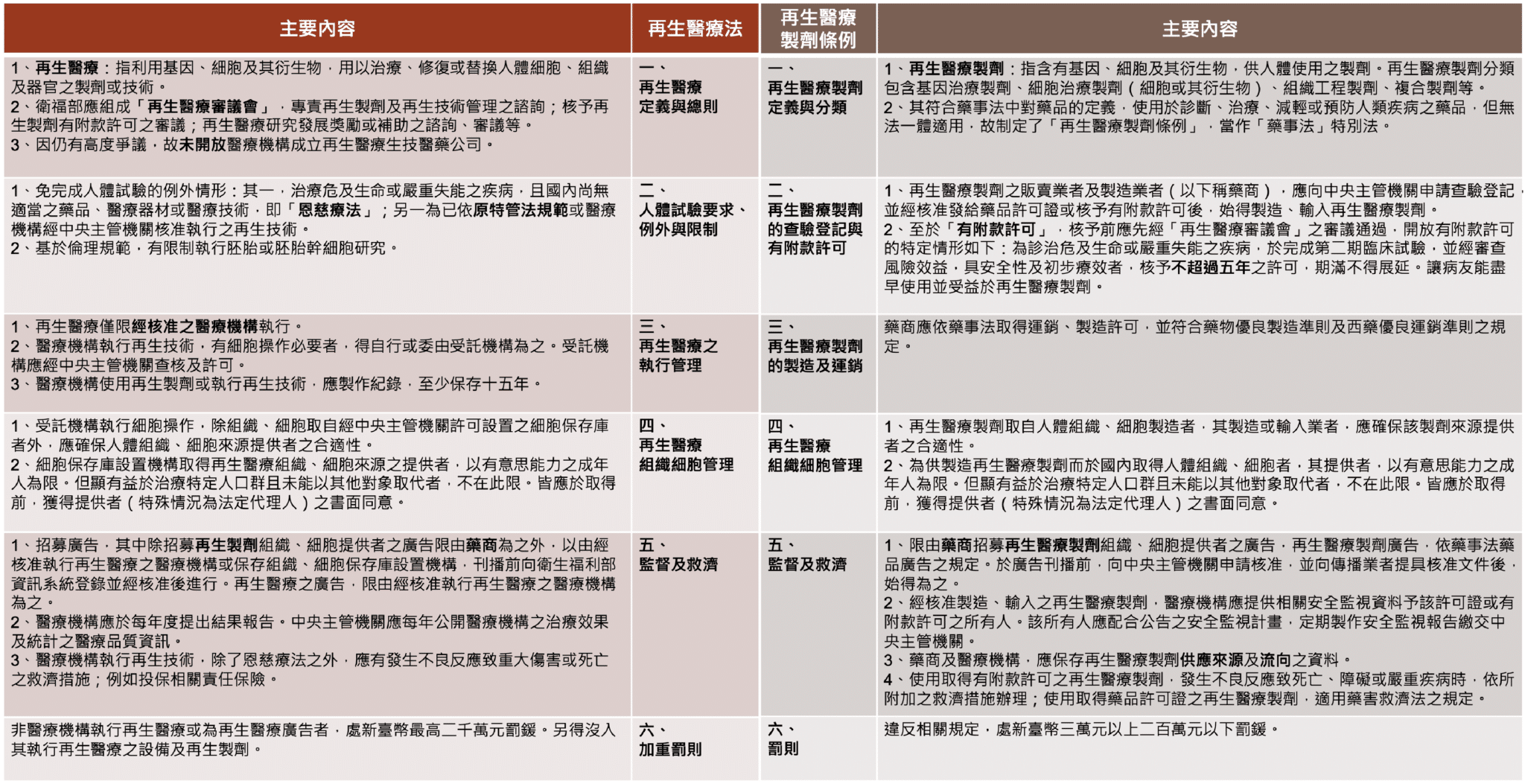
2024年6月,研議多年的「再生醫療法」及「再生醫療製劑條例」終於在立法院三讀通過。由衛福部醫事司主管的「再生醫療法」立法後,居行政命令位階的「特管辦法」中,有關細胞治療技術的章節正式落幕,而將再生醫療技術的管理強化至法律位階,台灣成為繼日、韓之後,第三個為再生醫療制定專法的亞洲國家,著實為台灣醫療進程的一個里程碑。簡言之,「再生醫療法」規範執行醫療技術,「再生醫療製劑條例」則以藥品來要求,以醫療技術(技術)與醫療製劑(藥品)雙軌制來進行。本文特別整理了「再生醫療法」與「再生醫療製劑條例」的六大重點(附表二),有助於讀者比較兩者的差異性。
附表二:再生醫療法與再生醫療製劑條例六大重點(點擊另開新視窗)
再生醫療的成本高、缺乏實證療效,縱使有諸多正反意見,去年中再生醫療雙法仍然取得專家共識而拍板通過,為再生醫療行為把關。不僅規範了再生醫療的施行標準、維護了病人權益,從再生醫療安全、品質及有效性的根本來出發;也代表國家大力支持國內再生醫療的發展,有望加速再生醫療研發成果應用至臨床醫學。超基因生技身為國內合法的再生醫療領域一員,始終秉持著誠信專業的態度關心守護每一個客戶。隨著再生醫療雙法的華麗轉身,對於未來再生醫學的應用將有無限可能,讓我們拭目以待吧!
參考資料:
- 再生醫療法(2024)
- 再生醫療製劑條例(2024)
- 陳淑玲(2023)。臺灣細胞治療技術法規簡介及現況。當代醫藥法規月刊, 第147期。財團法人醫藥品查驗中心